Генная терапия
Новаторское будущее медицины
Генная терапия представляет собой революционный подход к лечению и профилактике заболеваний на самом фундаментальном уровне — уровне генетического кода. Точно изменяя ДНК пациента, эта передовая технология способна исправлять генетические дефекты, блокировать вредные мутации или вводить терапевтические гены для борьбы с болезнями. Замена повреждённых генов, деактивация проблемных или усиление функций клеток открывают путь к ранее немыслимым методам лечения.
Будучи краеугольным камнем медицины нового поколения, мы стремимся развивать эти инновации, чтобы изменить результаты в сфере здравоохранения.
Как работает генная терапия:
Переписывая код жизни
Генная терапия борется с заболеванием на его корне, точно редактируя ДНК пациента. Используя прорывные методы доставки, учёные могут внедрять, заменять или "выключать" дефектные гены — как будто устанавливают корректирующий «патч» в биологическое программное обеспечение организма.
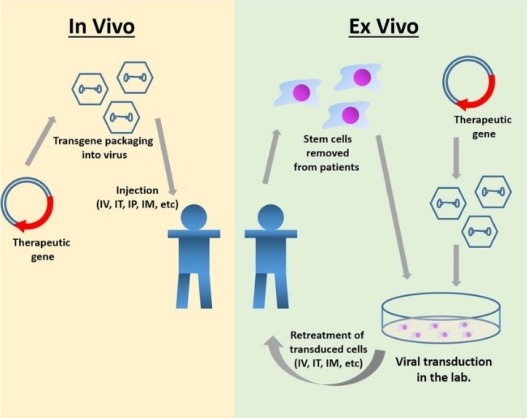
Два революционных подхода
1. Ex Vivo-терапия: редактирование вне организма, возвращение внутрь
Клетки извлекают у пациента, генетически модифицируют в лаборатории (часто с использованием вирусных векторов или CRISPR) и возвращают обратно — по сути, «обновляя» собственные клетки организма перед их повторным введением.
Пример: CAR-T-терапии для лечения рака.
2. In Vivo-терапия: прямая доставка
Генетические «грузы» (например, модифицированные вирусы или липидные наночастицы) вводятся непосредственно в организм, нацеливаясь на конкретные клетки in situ представьте себе микроскопическую «ремонтную бригаду», отправленную прямо к проблеме.
Пример: Luxturna для лечения наследственной слепоты.
Почему это прорыв
В отличие от традиционных препаратов, которые лишь контролируют симптомы, генная терапия предлагает однократные, потенциально излечивающие решения для генетических заболеваний.
Достижения Китая в области генной терапии
- 2019: Китай стал одной из первых стран, одобривших терапию CAR-T-клетками (Fosun Kite, Шанхай).
2022–2025: В Китае зарегистрировано более 120 активных клинических исследований в области генной терапии, охватывающих онкологию, редкие заболевания и сердечно‑сосудистые патологии.
Пекинская больница Тяньтань, Шанхайская больница Жуйцзинь и Медицинский центр Чжэцзянского университета входят в число пионеров, проводящих исследования в сфере генного редактирования и аутологичных стволовых клеточных терапий.
Будущее генной терапии в Китае и в мире
Китай активно инвестирует в следующие направления:
технологии CRISPR-Cas9 и базового редактирования генома;
аллогенную генную терапию (с использованием донорских клеток);
масштабируемые производственные платформы для вирусных векторов и генетически модифицированных клеток.
По мере усиления международного сотрудничества Китай становится не только лидером в области инноваций, но и центром разработки и клинического внедрения решений с более эффективными затратами.
Новые тенденции:
интеграция с искусственным интеллектом для поиска и разработки лекарств;
создание персонализированных генетических терапий, ориентированных на индивидуальный геном;
расширение применения в области метаболических заболеваний, нейродегенеративных расстройств и аутоиммунных патологий.
Проблемы и ключевые аспекты генной терапии: освоение новых рубежей
Хотя генная терапия обладает трансформационным потенциалом, её путь к широкому внедрению сопряжён с преодолением важных научных и этических препятствий. Понимание этих вызовов помогает формировать реалистичные ожидания и ускоряет прогресс.
1. Доставка: точность имеет значение
Эффективная и безопасная доставка генетического материала в целевые клетки остаётся серьёзной задачей. Вирусные векторы (например, AAV) и липидные наночастицы многообещающи, но сталкиваются с:
Биологическими барьерами (например, гематоэнцефалическим барьером при лечении неврологических заболеваний).
Ограничениями дозировки (слишком мало — неэффективно; слишком много — токсично).
2. Иммунный ответ: «файрвол» организма
Иммунная система может атаковать:
Вирусные векторы (даже ослабленные).
Терапевтические гены (воспринятые как «чужеродные»).
Решения: иммуносупрессия или более незаметные системы доставки (например, инженерные капсиды).
3. Побочные эффекты: избегание нежелательных изменений
Инструменты типа CRISPR несут риск непреднамеренных правок («геномных опечаток»). Стратегии снижения риска включают:
Высокоспецифичные нуклеазы (например, базовые редакторы).
Модели прогнозирования на базе ИИ для минимизации ошибок.
4. Долгосрочные эффекты: неизведанная территория
Долговечность: будет ли терапия действовать десятилетиями или потребуются повторные курсы?
Поздние риски: необходим постоянный мониторинг (например, пациенты с SCID после лечения).
5. Мультигенные заболевания: сложность задачи
Болезни, такие как болезнь Альцгеймера или сердечные патологии, связаны с множеством генов, что усложняет терапию. Возможные решения:
Полигенные рисковые оценки и комбинированные терапии.
Таргетинг генетических сетей с помощью системной биологии.
Почему важна прозрачность
Открытое обсуждение вызовов формирует доверие у пациентов, инвесторов и регуляторов — ключевой фактор для успешного развития области.




